Tembaga(I) klorida
 | |
 | |
| Nama | |
|---|---|
| Nama IUPAC Copper(I) chloride | |
| Nama lain Kupro klorida | |
| Penanda | |
Nomor CAS |
|
Model 3D (JSmol) |
|
| 3DMet | {{{3DMet}}} |
| ChEBI |
|
| ChemSpider |
|
| Nomor EC | |
PubChem CID |
|
| Nomor RTECS | {{{value}}} |
CompTox Dashboard (EPA) |
|
InChI
| |
SMILES
| |
| Sifat | |
Rumus kimia | CuCl |
| Massa molar | 98,999 g/mol |
| Penampilan | serbuk putih, agak kehijauan karena produk oksidasinya |
| Densitas | 4,145 g/cm3 |
| Titik lebur | 426 °C (799 °F; 699 K) |
| Titik didih | 1.490 °C (2.710 °F; 1.760 K) (terdekomposisi) |
Kelarutan dalam air | 0,0062 g/100 mL (20 °C) |
| Hasil kali kelarutan, Ksp | 1,72×10−7 |
| Kelarutan | tidak larut dalam etanol aseton; larut dalam HCl pekat, NH |
| Indeks bias (nD) | 1,930[1] |
| Struktur | |
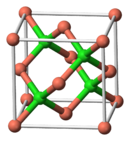
| Struktur zinc blende | |
| Bahaya | |
| Lembar data keselamatan | JT Baker |
Klasifikasi UE (DSD) (usang) | Berbahaya (Xn) Berbahaya bagi lingkungan (N) |
| Frasa-R | R22, R50/53 |
| Frasa-S | S2, S22, S60, S61 |
| Titik nyala | Tidak menyala |
| Dosis atau konsentrasi letal (LD, LC): | |
LD50 (dosis median) | 140 mg/kg |
| Batas imbas kesehatan AS (NIOSH): | |
PEL (yang diperbolehkan) | TWA 1 mg/m3 (sebagai Cu)[2] |
REL (yang direkomendasikan) | TWA 1 mg/m3 (sebagai Cu)[2] |
IDLH (langsung berbahaya) | TWA 100 mg/m3 (sebagai Cu)[2] |
| Senyawa terkait | |
Anion lain | Tembaga(I) bromida Tembaga(I) iodida |
Kation lainnya | Tembaga(II) klorida Perak(I) klorida |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
 Y verifikasi (apa ini Y verifikasi (apa ini  Y Y N ?) N ?) | |
| Referensi | |

Tembaga(I) klorida, sering disebut sebagai kupro klorida, adalah klorida tembaga paling rendah, dengan rumus CuCl. Senyawa ini berupa padatan putih yang larut sebagian dalam air, tetapi sangat mudah larut dalam asam klorida pekat. Sampel yang mengandung ketakmurnian (impurities) berwarna kehijauan karena adanya tembaga(II) klorida.[3]
Sejarah
Tembaga(I) klorida pertama kali dibuat oleh Robert Boyle pada pertengahan abad ketujuhbelas[4] dari raksa(II) klorida ("sublimat Venesia") dan logam tembaga:
Pada tahun 1799, J.L. Proust mengidentifikasi dua klorida tembaga yang berbeda. Ia menyiapkan CuCl dengan memanaskan CuCl pada temperatur tinggi tanpa keberadaan udara, menyebabkan kehilangan setengah dari klorin terikat diikuti dengan pencucian residu CuCl menggunakan air.[5]
Larutan CuCl dalam suasana asam pernah digunakan untuk analisis kandungan karbon monoksida dalam gas, misalnya dalam peralatan gas Hempel.[6] Aplikasi ini sangat signifikan[7] saat itu ketika gas batubara (coal gas banyak digunakan untuk pemanas dan penerangan, selama abad ke-19 hingga awal abad ke-20.
Sintesis
Tembaga(I) klorida disintesis dengan cara mereduksi tembaga(II) klorida, misalnya dengan belerang dioksida:
Banyak pereduksi lain yang dapat digunakan.[8]
Sifat kimia
-
 Kristal tembaga(I) klorida putih pada kawat tembaga
Kristal tembaga(I) klorida putih pada kawat tembaga -
 Tembaga(I) klorida teroksidasi sebagian di udara
Tembaga(I) klorida teroksidasi sebagian di udara
Tembaga(I) klorida adalah asam Lewis, yang diklasifikasikan sebagai lemah menurut Konsep Asam-Basa Kuat-Lemah. Oleh karena itu, cenderung membentuk senyawa kompleks yang stabil dengan basa Lewis lemah seperti trifenilfosfin, P(C6H5)3:
Meskipun CuCl tidak larut dalam air, ia larut dalam larutan akuatik yang mengandung molekul donor yang sesuai. Ia membentuk senyawa kompleks dengan ion halida, misalnya membentuk H CuCl dengan asam klorida pekat. Ia diserang oleh CN, S, dan NH menghasilkan kompleks yang sesuai.
Larutan CuCl dalam HCl atau NH menyerap karbon monoksida membentuk kompleks tak berwarna seperti dimer jembatan klorida [CuCl(CO)]2. Larutan asam klorida yang sama juga bereaksi dengan gas asetilena membentuk [CuCl(C2H2)]. Larutan amoniakal CuCl bereaksi dengan asetilena membentuk tembaga(I) asetilida Cu yang mudah meledak. Kompleks CuCl dengan alkena dapat dibuat dengan mereduksi [[Tembaga(II) klorida|CuCl dengan belerang dioksida dengan kehadiran alkena dalam larutan alkohol. Kompleks dengan diena seperti 1,5-siklooktadiena khususnya stabil:[9]

Referensi
- ^ Pradyot Patnaik (2002), Handbook of Inorganic Chemicals, McGraw-Hill, ISBN 0-07-049439-8
- ^ a b c "NIOSH Pocket Guide to Chemical Hazards #0150". National Institute for Occupational Safety and Health (NIOSH).
- ^ "Method of Preparing Cupric Ion Free Cuprous Chloride" (PDF), www.freepatentsonline.com, United States Patent US4582579, Section 2, Lines 4-41
- ^ Boyle, Robert (1666). Considerations and experiments about the origin of forms and qualities. Oxford. As reported in Mellor.
- ^ Proust, J. L. (1799). Ann. Chim. Phys. (1). 32: 26. Tidak memiliki atau tanpa
|title=(bantuan) - ^ Martin, Geoffrey (1917). Industrial and Manufacturing Chemistry (edisi ke-Part 1, Organic). London: Crosby Lockwood. hlm. 330–31.
- ^ Lewes, Vivian H. (1891). "Journal of the Society of Chemical Industry". Journal of the Society of Chemical Industry. 10: 407–413.
- ^ O. Glemser and H. SauerR (1963), "Copper(I) Chloride", dalam G. Brauer, Handbook of Preparative Inorganic Chemistry, 1 (edisi ke-2nd), NY.: Academic Press, hlm. 1005 Pemeliharaan CS1: Menggunakan parameter penulis (link)
- ^ Nicholls, D. (1973), Complexes and First-Row Transition Elements, London: Macmillan Press
Bacaan lain
- Mellor, J.W. (1967), A Comprehensive Treatise on Inorganic and Theoretical Chemistry, III (edisi ke-new impression), London: Longmans, Green & Co., hlm. 157–168 .
Pranala luar

- National Pollutant Inventory - Copper and compounds fact sheet Diarsipkan 2008-03-02 di Wayback Machine.
- The COPureSM Process for purifying CO utilizing a copper chloride complex
- l
- b
- s
- Cu5Si
- CuBr
- CuCN
- CuCl
- CuF
- CuH
- CuI
- Cu2C2
- Cu2Cr2O5
- Cu2O
- CuOH
- Cu2S
- Cu3P
- Cu(BF4)2
- CuBr2
- CuC2
- Cu(CN)2
- CuCO3
- CuCl2
- CuF2
- Cu(NO3)2
- Cu3(PO4)2
- CuN6
- CuO
- Cu(OH)2
- CuI2
- CuS
- CuSO4
- Cu3(AsO4)2
- K3CuF6
- Cu2O3
- Cs2CuF6
- Rb2CuF6




![{\displaystyle {\text{CuCl}}+{\text{P(C}}_{6}{\text{H}}_{5}{\text{)}}_{3}\longrightarrow \left[{\text{CuCl(P(C}}_{6}{\text{H}}_{5}{\text{)}}_{3}{\text{)}}\right]_{4}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3708019f9b2a17785d9e45842bf2a6d35573f80a)








